La flessibilità metabolica nei soggetti sani e patologici
- ISEC Team
- 16 nov 2021
- Tempo di lettura: 34 min
Traduzione da Cell Metab. 2017 May 2; 25(5): 1027–1036.
La flessibilità metabolica è la capacità di rispondere o adattarsi ai cambiamenti indotti dalle richieste energetiche. Questo ampio concetto è stato proposto per spiegare la resistenza all'insulina e i meccanismi che regolano la selezione del carburante tra glucosio e acidi grassi, evidenziando l'inflessibilità metabolica dell'obesità e del diabete di tipo 2. Parallelamente, la ricerca contemporanea sulla fisiologia dell'esercizio ha aiutato a identificare i potenziali meccanismi alla base dell'alterazione del carburante metabolico nell'obesità e nel diabete. I progressi nelle tecnologie "omiche" hanno ulteriormente stimolato altre ricerche di base e clinico-traduzionali per interrogare ulteriormente i meccanismi rivolti a una migliore flessibilità metabolica nel muscolo scheletrico e nel tessuto adiposo con l'obiettivo di prevenire e curare le malattie metaboliche.
Cosa è la flessibilità metabolica?
La flessibilità metabolica descrive la capacità di un organismo di rispondere o adattarsi in base ai cambiamenti nella domanda metabolica o energetica, nonché alle condizioni o attività prevalenti. È stato usato per la prima volta come termine che descrive l'aumentata capacità degli elminti, un verme parassita, di generare energia chimica e metaboliti chiave sia in modo aerobico che utilizzando la respirazione anaerobica per dargli una maggiore versatilità e flessibilità metabolica per rispondere e adattarsi ai cambiamenti ambientali nel suo habitat (Kohler, 1985).
Il concetto più comune di flessibilità metabolica è stato promulgato nel contesto della selezione del carburante nella transizione dal digiuno allo stato di alimentazione, o dal digiuno alla stimolazione dell'insulina per spiegare la resistenza all'insulina (Goodpaster e Kelley, 2008). L'originale Randle Cycle (Randle et al., 1963) è stato proposto come principio per spiegare l'elevata ossidazione degli acidi grassi e la ridotta ossidazione del glucosio alla base della resistenza all'insulina e del diabete di tipo 2. Kelley e Mandarino hanno successivamente riconsiderato questi concetti a seguito di una serie di interessanti studi in vivo che dimostrano l'inflessibilità metabolica nel diabete di tipo 2 umano e nell'obesità in cui, durante le condizioni post-assorbimento, il muscolo scheletrico ha un'elevata ossidazione del glucosio e una ridotta ossidazione degli acidi grassi ( Kelley, 1994, 1993; Kelley e Mandarino, 1990; Kelley et al., 1993). Da quando sono stati descritti quei primi esperimenti, il termine flessibilità metabolica si è evoluto per comprendere altre circostanze e tessuti metabolici e si riferisce più in generale a un'adattabilità fisiologica. È stato anche dedotto che la flessibilità metabolica ha specificità tissutale in risposta a condizioni notturne e diurne a digiuno e alimentazione (Kelley et al., 1999).
L'esercizio fisico è un'altra condizione fisiologica che richiede flessibilità metabolica per far corrispondere la disponibilità di carburante con il meccanismo metabolico per soddisfare enormi aumenti della domanda di energia. La durata e l'intensità dell'esercizio possono influenzare profondamente la domanda di energia, modificando così le riserve di energia e le vie cataboliche in modi molto diversi. Sebbene l'argomento dei cambiamenti nel metabolismo indotti dall'esercizio sia stato trattato in recenti revisioni (vedi (Egan e Zierath, 2013; Hawley et al., 2014)), i meccanismi alla base della flessibilità metabolica con l'esercizio meritano ulteriori indagini. La "plasticità muscolare" è stata utilizzata per la prima volta (Pette, 1980) come termine usato per caratterizzare la capacità del muscolo di rispondere a una varietà di stimoli e includeva una flessibilità metabolica. L'esercizio fisico può alterare l'immagazzinamento e la disponibilità di carburante e recenti prove che l'esercizio promuove cambiamenti nell'epigenoma del muscolo scheletrico (Rasmussen et al., 2014), trascrittoma (Keller et al., 2011; Raue et al., 2012) e proteoma (Hoffman et al., 2015), che costituiscono tutti una flessibilità anabolica per soddisfare i cambiamenti nei requisiti energetici per ogni sessione di esercizio o attività, meritano indagini più approfondite sui meccanismi molecolari che guidano la flessibilità metabolica.
Qualsiasi revisione o discussione di questi concetti generali di flessibilità metabolica merita di essere collocata in un qualche contesto e quadro; perché senza questo, la recensione potrebbe essere troppo ampia e ingombrante. Rivedremo i processi e alcuni dei meccanismi sottostanti delle risposte metabolicamente flessibili sane al digiuno e all'alimentazione e dal riposo all'esercizio fisico, e con alcune deduzioni all'inflessibilità metabolica in relazione alla patobiologia. In questo contesto, esamineremo le prove che l'esercizio fisico può migliorare la flessibilità metabolica, molto importante per migliorare gli aspetti fisiopatologici dell'obesità, del diabete di tipo 2 e dell'invecchiamento. Cercheremo anche di riassumere le prove che confrontano e contrappongono gli effetti dell'allenamento fisico e della perdita di peso indotta dalla restrizione calorica sulla flessibilità metabolica e le implicazioni che questo probabilmente ha sulla prevenzione e sul trattamento di queste condizioni.
Sottolineiamo il ruolo del muscolo scheletrico e del tessuto adiposo nella flessibilità metabolica nell'uomo. Questi sono due tessuti, che svolgono un ruolo cruciale nel metabolismo energetico, ed entrambi sono accessibili nell'uomo con biopsie per interrogare la loro biologia e risposta agli interventi acuti e cronici. Indipendentemente dal tessuto, la flessibilità metabolica è guidata da processi cellulari e organelli, forse più pertinenti nei mitocondri. Qui abbiamo deliberato la flessibilità metabolica durante le condizioni rilevanti di digiuno, stimolazione dell'insulina ed esercizio fisico.
Dal digiuno all'alimentazione - La resistenza all'insulina come parte dell'inflessibilità metabolica nell'obesità e nel diabete di tipo 2
Il muscolo scheletrico guida il catabolismo del carburante
La tecnica originale di calorimetria indiretta dell'equilibrio degli arti stabilita da Andres e colleghi nel 1956 misurava l'ossidazione del glucosio e degli acidi grassi tramite il quoziente respiratorio (QR) del muscolo dell'avambraccio durante condizioni post-assorbimento (Andres et al., 1956). Hanno chiaramente dimostrato che la transizione normale e sana dal digiuno all'alimentazione comporta cambiamenti nella selezione del carburante dal metabolismo prevalentemente ossidativo degli acidi grassi a una maggiore ossidazione del glucosio nel muscolo scheletrico. Kelley e colleghi hanno successivamente dimostrato che questo cambiamento includeva anche, sebbene in misura quantitativamente minore, aumenti nella produzione di energia glicolitica (Kelley et al., 1999).
Poiché il dispendio energetico, principalmente dovuto all'effetto termico del cibo, aumenta di meno del 10% (Acheson et al., 1984), questo cambiamento di substrato serve a utilizzare in modo efficiente le fonti di energia in base al contenuto o alla miscela dei macronutrienti nel pasto. Lo scopo principale di questo cambiamento di substrato è quello di passare da processi catabolici a processi anabolici in cui l'energia può essere efficacemente immagazzinata nei muscoli scheletrici, nei tessuti adiposi e nel fegato. Il rilascio di insulina in risposta a un pasto è uno dei principali fattori di questo cambiamento.
Gran parte dell'attenzione sulla flessibilità metabolica è dovuta alla sua implicazione nella resistenza all'insulina, un concetto avanzato per la prima volta da Wilhelm Falta e pubblicato a Vienna nel 1931 come possibile causa sottostante del diabete di tipo 2 (Falta e Boller, 1931). Durante i successivi 85 anni la resistenza all'insulina si è evoluta fino a diventare generalmente accettata come il fattore predominante che porta al diabete di tipo 2 e il più probabile collegamento singolo tra una costellazione di fattori di rischio cardiometabolico noto come sindrome metabolica che collega obesità, diabete di tipo 2 e malattie cardiovascolari (Reaven, 1988).
Insulino-resistenza del muscolo scheletrico e metabolismo degli acidi grassi
La resistenza all'insulina è una componente chiave dell'inflessibilità metabolica che può svilupparsi in molti tessuti e organi. I meccanismi cellulari per la resistenza all'insulina sono stati ampiamente riesaminati (Flier et al., 1979; Holland e Summers, 2008; Shulman, 2004). Un'enfasi sostanziale sui meccanismi alla base della resistenza all'insulina nel fegato e nel muscolo scheletrico è stata posta sui ruoli dell'ossidazione degli acidi grassi mitocondriali alterata e dell'accumulo eccessivo di metaboliti lipidici diacilglicerolo e ceramidi.
Il muscolo scheletrico rappresenta circa il 60-80% dell'aumento del metabolismo del glucosio in risposta all'insulina (Ng et al., 2012). Intuitivamente, una riduzione della quantità di glucosio che entra nelle cellule muscolari e negli adipociti dal flusso sanguigno, insieme a una ridotta soppressione della produzione di glucosio epatico, aumenterà il glucosio nel sangue in assenza di un corrispondente aumento del rilascio di insulina dalle cellule beta pancreatiche . Il diabete si sviluppa, come si dice, se e quando le cellule beta non riescono a compensare adeguatamente questa resistenza all'insulina con una maggiore secrezione di insulina.
È difficile argomentare contro l'insulino-resistenza nei muscoli, nel tessuto adiposo e nel fegato che causa iperglicemia con compensazione delle cellule beta inappropriata o inefficiente. La resistenza all'insulina spesso precede l'iperinsulinemia e l'iperglicemia (DeFronzo e Tripathy, 2009). C'è, tuttavia, un certo dibattito sul fatto che la resistenza all'insulina nel muscolo sia un difetto primario o un adattamento nel diabete. Difetti nell'ossidazione degli acidi grassi (Kelley et al., 1999; Koves et al., 2008; McGarry, 1992), alterazione energetica mitocondriale (Lee et al., 2010; Morino et al., 2005) e accumulo di lipidi intramiocellulari (Amati et al., al., 2011; Coen et al., 2010) sono stati tutti associati a insulino-resistenza e diabete di tipo 2. Continua anche il dibattito controverso su quale tessuto o organo sia il principale responsabile della resistenza all'insulina di tutto l'organismo, dell'intolleranza al glucosio e del diabete. Turner et al. hanno fornito prove temporali in un modello di resistenza all'insulina di roditori nutriti ad alto contenuto di grassi per cui l'insulino-resistenza epatica precede sia il tessuto adiposo che l'insulino-resistenza del muscolo scheletrico (Turner et al., 2013). Questo studio evidenzia anche l'importante ruolo del metabolismo degli acidi grassi non regolato e dell'eccesso di lipidi che causano la resistenza all'insulina in questi tessuti sensibili all'insulina. Ulteriori prove nell'uomo suggeriscono che la resistenza all'insulina dei muscoli scheletrici e a livello epatico potrebbe verificarsi contemporaneamente (Chen et al., 2015). È quindi probabile che lo stimolo iniziale per causare l'insulino-resistenza e il diabete di tutto il corpo possa avere origine all'interno di diversi tessuti.
Indipendentemente dal fatto che l'insulino-resistenza muscolare possa causare o meno il diabete di tipo 2, è probabile che l'insulino-resistenza faccia parte di un'inflessibilità metabolica complessiva che comprende anche i difetti del metabolismo degli acidi grassi. Dal punto di vista cellulare, l'eccesso di glucosio che entra e viene immagazzinato nella cellula muscolare in assenza di un aumento del dispendio energetico potrebbe essere dannoso. La resistenza all'insulina è quindi una risposta adattativa? Ci sono certamente condizioni fisiologiche in cui si sviluppa la resistenza all'insulina, che non è patobiologica. Il digiuno prolungato induce la resistenza all'insulina del muscolo scheletrico parallelamente all'elevata ossidazione degli acidi grassi (Hoeks et al., 2010). Allo stesso modo, il sovraccarico lipidico, spesso utilizzato come modello per l'insulino-resistenza (Brehm et al., 2006; Itani, 2002; Yu, 2002), può rappresentare un modello di flessibilità metabolica piuttosto che rivelare un meccanismo patologico di insulino-resistenza. A sostegno di ciò, Phelix et al. e Dube et al. dimostrato in studi indipendenti (Dube et al., 2014; Phielix et al., 2012) che gli atleti allenati alla resistenza che hanno un'elevata capacità ossidativa nei muscoli possono aumentare l'ossidazione degli acidi grassi in risposta al sovraccarico di lipidi, ma preservano l'accumulo di glicogeno all'interno del muscolo a scapito della diminuzione dell'ossidazione del glucosio (Figura 1, dati ottenuti da (Dube et al., 2014)). Questa maggiore flessibilità metabolica è stata associata a una maggiore capacità mitocondriale nei muscoli allenati all'esercizio (Dube et al., 2014; Phielix et al., 2012). Prove recenti suggeriscono anche che la variazione circadiana nel meccanismo metabolico molecolare può influenzare la flessibilità metabolica (Bass e Lazar, 2016). Questa è un'area di indagine emergente che aiuterà a chiarire il ruolo dell'insulino-resistenza e della flessibilità metabolica nella salute e nelle malattie umane.

Il tessuto adiposo bianco regola i flussi energetici
Rispetto al muscolo scheletrico, sono riportate relativamente poche ricerche sulla flessibilità metabolica del tessuto adiposo bianco (WAT). Il WAT è stato storicamente considerato un serbatoio di lipidi; tuttavia, il WAT sta diventando sempre più riconosciuto per svolgere un ruolo attivo nel metabolismo dei lipidi e del glucosio, oltre ad avere il potenziale per aumentare la termogenesi (o "imbrunimento") (Bostrom et al., 2012; Nedergaard e Cannon, 2014; Stanford et al. ., 2015). Ai fini di questa review, ci concentriamo sugli aspetti intrinseci del metabolismo del WAT e non affrontiamo le complessità altamente dibattute della "browning" del WAT. Il WAT regola la circolazione degli acidi grassi liberi (FFA) per i tessuti periferici come il muscolo scheletrico e il fegato attraverso un sistema calibrato di assorbimento, esterificazione e rilascio di FFA (il cosiddetto ciclo del triacilglicerolo [TAG]) (Reshef et al., 2003). Questo processo richiede, tra molti altri, la glicerolo chinasi, un enzima che si pensava fosse assente negli adipociti prima di un innovativo studio in vitro nel 2002 (Guan et al., 2002). Vale la pena notare che il ciclo del TAG si verifica anche all'interno del tessuto adiposo bruno (BAT) (Yu et al., 2002), ma la flessibilità metabolica del BAT è più correlata al ciclo del TAG legato alla combustione all'interno della cellula piuttosto che all'immagazzinamento e all'approvvigionamento per i tessuti periferici come nel caso del WAT. Mentre l'assenza (Reitman e Gavrilova, 2000) o l'eccesso (obesità) di WAT sono entrambi associati a complicazioni metaboliche, una donna sana di peso normale può avere tanto WAT quanto un uomo obeso con diabete di tipo 2 (Jensen, 2002). La massa WAT di per sé non è quindi l'unico colpevole delle anomalie metaboliche causate dall'obesità, evidenziando l'importanza di un WAT sano e metabolicamente adattabile. Allo stesso modo, è pertinente notare che i depositi adiposi viscerali e sottocutanei sono altamente correlati negli studi trasversali (Fox et al., 2007), il che rende difficile districare i loro contributi individuali alla salute metabolica. L'obiettivo principale di questa revisione è il tessuto adiposo sottocutaneo addominale.
Prove sostanziali implicano livelli elevati di FFA [da lipolisi inappropriata] come un fattore eziologico significativo per la resistenza all'insulina e il diabete di tipo 2 (Eckel et al., 2005; Frayn e Coppack, 1992; Frayn et al., 1996; Randle et al., 1963 ; Selvaggio et al., 2007). Studi più contemporanei, tuttavia, hanno confutato la relazione tra elevati FFA circolanti e insulino-resistenza guidata dall'obesità. Per riassumere questi risultati, una recente analisi sistematica di Frayn e colleghi ha confrontato oltre 2.000 individui sovrappeso/obesi con non obesi e ha scoperto che la differenza media tra queste due gruppi era modesta (nell'intervallo di 70 μmol/L) e non correlata a massa grassa (Karpe et al., 2011). Negli esseri umani, l'unico sito significativo di liberazione di FFA è il WAT addominale sottocutaneo (cioè la parte superiore del corpo) con solo una piccola e piuttosto insignificante proporzione derivante dal tessuto adiposo viscerale (Nielsen et al., 2004). La transizione dal digiuno all'alimentazione provoca una soppressione della lipolisi in WAT stimolata dall'insulina, un processo che si verifica tramite percorsi di segnalazione Akt-dipendenti e Akt-indipendenti (Choi et al., 2010). Negli individui non obesi, l'EC50 dell'insulina per sopprimere la lipolisi è la metà di quella necessaria per sopprimere la produzione di glucosio (epatico) dal fegato (Nurjhan et al., 1986). Nello soggetto diabetico la quantità di insulina necessaria per sopprimere completamente la produzione epatica di glucosio raggiunge solo una soppressione dell'85% della lipolisi adiposa (Groop et al., 1989). Questi studi enfatizzano la sensibilità (e la flessibilità) del WAT all'insulina in uno stato sano e mettono in evidenza la sua suscettibilità alla risposta insulinica ridotta come un potenziale punto iniziale di aberrazione nell'eziologia della resistenza all'insulina di tutto il corpo e del diabete di tipo 2.

La Figura 2 cattura il potere dell'adattabilità metabolica del WAT per influenzare il metabolismo in altri tessuti come il muscolo scheletrico. Una smussata soppressione della lipolisi da parte dell'insulina durante un clamp euglicemico iperinsulinemico è associata a un ridotto catabolismo glicolitico e flessibilità metabolica nelle persone sane (2a) (Sparks et al., 2009), e segrega in base allo stato di diabete, piuttosto che alla massa grassa (2b) (dati non pubblicati). Il digiuno notturno provoca un'elevata attività lipolitica in WAT per un robusto apporto di FFA (Frayn et al., 1996) e tassi commisuratamente elevati di ossidazione dei grassi nel muscolo scheletrico (basso RQ), un'abilità che è smussata negli individui con una storia familiare di tipo 2 diabete (Ukropcova et al., 2007). Nel contesto della sensibilità all'insulina del WAT (EC50) (Nurjhan et al., 1986), sono necessari bassi livelli di insulina affinché il WAT possa affrontare questa sfida della domanda di FFA indotta dal digiuno. Quando le oscillazioni della secrezione di insulina sono attenuate e/o assenti, come nelle persone con una storia familiare di diabete di tipo 2 (Matthews, 1996; O'Rahilly et al., 1988), il WAT può sviluppare resistenza all'insulina come risposta adattativa o difesa meccanismo per continuare a fornire FFA al muscolo scheletrico e ad altri tessuti secondo necessità. La patobiologia è quindi difficile da determinare senza un contesto condizionale.
Una considerevole riesterificazione degli FFA in WAT si verifica durante i periodi di lipolisi attiva come il digiuno; negli esseri umani a digiuno per 60 ore, circa il 40% degli FFA liberati viene riciclato in TAG nel deposito sottocutaneo di WAT (Jensen et al., 2001), e il resto degli FFA viene rilasciato dal WAT in circolo per il catabolismo da parte di altri tessuti, tipicamente muscolo scheletrico. Il WAT possiede una notevole capacità di adattamento nell'obesità per espandere e immagazzinare continuamente gli FFA inerti come sua funzione innata, che spesso può essere perturbata nell'insulino-resistenza guidata dall'obesità e si traduce in una down-regulation della base (digiuno) (Campbell et al., 1994; Horowitz et al., 1999) e accumulo di grassi alimentari (McQuaid et al., 2011). I tiazolidinedioni (TZD) migliorano notevolmente la sensibilità all'insulina e l'omeostasi del glucosio espandendo il WAT (Girard, 2001) attraverso un aumento indotto dal recettore attivato dal proliferatore dei perossisomi (PPAR)-γ nei livelli di GyK e nel ciclo di TAG in condizioni di digiuno e alimentazione ed eliminano la dipendenza da glucosio per tali processi (Guan et al., 2002; Lehmann et al., 1995). La riesterificazione è più evidente dopo l'ingestione di un pasto misto quando l'insulina induce il passaggio dal rilascio di FFA alla conservazione. La Figura 3 illustra elegantemente la capacità anabolica del WAT. Nel corso di tre pasti in un periodo di 24 ore, gli uomini obesi addominali hanno un flusso transcapillare di AF (deposito e rilascio netto di grasso) significativamente più basso dal WAT (McQuaid et al., 2011). Intuitivamente, poiché meno FFA dietetici vengono progressivamente immagazzinati in WAT ad ogni pasto, questi FFA rimangono in circolazione e sono probabilmente depositati ectopicamente in altri tessuti e portano a perturbazioni metaboliche in essi. La Figura 4 mostra un aumento progressivo dell'QR post-pasto (quindi bruciando più carboidrati che grassi) entro il 3° dei 3 pasti in un periodo di 24 ore in individui sani magri (dati non pubblicati). L'essenza della flessibilità metabolica coordinata tra i tessuti nello stato sano impone che più grasso è immagazzinato (e inertemente sequestrato) nel WAT post-pasto, meno grasso è disponibile per il catabolismo da parte di altri tessuti, portando a una maggiore dipendenza dall'ossidazione dei carboidrati (QR più alto).


Riposo per l'esercizio – Selezione del carburante per supportare l'aumento della domanda di energia
L'attività fisica può aumentare notevolmente il dispendio energetico. L'esercizio vigoroso può aumentare il dispendio energetico di 25 volte rispetto al metabolismo a riposo. La fisiologia e la biochimica della selezione del carburante durante l'esercizio sono state oggetto di indagine per diversi decenni. La stragrande maggioranza degli studi sull'uomo è stata condotta su soggetti giovani normopeso che tipicamente hanno una notevole flessibilità metabolica nella selezione del carburante. Questi concetti e gli sforzi profusi per comprendere meglio il metabolismo del carburante durante l'esercizio sono nati in gran parte anche dall'interesse a migliorare le prestazioni sportive. La letteratura è ricca di studi volti a strategie per prolungare la resistenza mantenendo tassi più elevati di ossidazione degli acidi grassi (Jeukendrup et al., 1996; Jeukendrup et al., 1998a; Jeukendrup et al., 1998b; van Loon et al., 1999 ) e l'ossidazione esogena dei carboidrati (Goodpaster et al., 1996; Horowitz et al., 1999) per preservare le riserve di glicogeno muscolare, che ha dimostrato di limitare le prestazioni.
Il muscolo scheletrico rappresenta oltre il 95% del fabbisogno energetico durante un esercizio da moderato a vigoroso. Il glicogeno intramuscolare, i trigliceridi, il glucosio plasmatico e gli acidi grassi plasmatici (principalmente dalla lipolisi WAT sottocutanea addominale) si combinano per fornire il carburante necessario al muscolo in attività (Romijn, 1993). Quindi l'esercizio richiede un'enorme flessibilità metabolica per aumentare l'apporto di energia da tutte queste fonti per supportare l'enorme richiesta di energia dell'esercizio principalmente da parte del muscolo scheletrico.
Molti dei cambiamenti miocellulari che si verificano durante l'esercizio, non a caso, sono legati al catabolismo. L'esercizio è un potente attivatore di AMPK (Jorgensen et al., 2006), che è stato costantemente segnalato come un sensore di energia principale. L'attivazione farmacologica dell'AMPK altera l'espressione di molti degli stessi geni osservati con l'esercizio (Narkar et al., 2008). Le vie delle sirtuine sono state anche implicate nei meccanismi di rilevamento dell'energia nel muscolo scheletrico e in molti altri tessuti che richiedono flessibilità metabolica (Jing et al., 2011). L'esercizio altera in modo acuto il meccanismo molecolare e biochimico necessario per mobilitare l'energia per l'ossidazione dei carboidrati e degli acidi grassi. Questi cambiamenti nel muscolo scheletrico favoriscono un maggiore apporto energetico. La flessibilità metabolica per passare dal catabolismo del glucosio a quello degli acidi grassi durante l'esercizio acuto nelle persone sane è determinata in gran parte dall'intensità e dalla durata dell'esercizio. L'esercizio ad alta intensità si basa sempre più sull'ossidazione del glucosio, attraverso la fosforilazione ossidativa, ma più esclusivamente sulla glicolisi anaerobica durante l'esercizio ad alta intensità. Ciò si verifica indipendentemente dall'insulina (Goodyear e Kahn, 1998), poiché i livelli di insulina circolante sono normalmente molto bassi durante l'esercizio. L'ossidazione degli acidi grassi contribuisce quantitativamente e proporzionalmente meno all'aumentare dell'intensità dell'esercizio (Brooks, 1997; Romijn, 1993). Man mano che la durata dell'esercizio diventa più lunga, tuttavia, gli acidi grassi contribuiscono maggiormente all'approvvigionamento energetico complessivo (Jeukendrup, 2002).
Un aspetto della flessibilità metabolica del WAT è la capacità di mobilizzare gli FFA (principalmente dal WAT addominale sottocutaneo) in risposta a un aumento acuto delle catecolamine mediato dall'esercizio (Arner et al., 1990b). Il tessuto adiposo viscerale sembra essere più sensibile all'attivazione adrenergica (Arner, 1995; Mauriege et al., 1987). Infatti, alcuni studi hanno dimostrato che il deposito adiposo viscerale (rispetto a quello sottocutaneo) ha un cambiamento relativo maggiore in risposta agli interventi di esercizio (Schwartz et al., 1991; Thomas et al., 2000). Il deposito adiposo sottocutaneo addominale è ancora considerato il più grande fornitore di FFA plasmatici durante un periodo di esercizio acuto con viscerale che fornisce una frazione molto piccola poiché il deposito viscerale è di dimensioni molto più piccole (specialmente nello stato sano) (Horowitz, 2003). Anche l'esercizio a bassa intensità aumenta la concentrazione di adrenalina fino a circa tre volte superiore a quella basale (Henderson et al., 2007; McMurray et al., 1987). All'aumentare della durata dell'esercizio a intensità fissa, vi è un aumento della lipolisi WAT regionale (Stallknecht et al., 2007; Stallknecht et al., 2001; Stich et al., 2000), che è stata attribuita agli ormoni ad azione lenta come l'ormone della crescita (Divertie et al., 1991; Hansen et al., 2005; Healy et al., 2006). Il blocco selettivo dei recettori β-adrenergici nella WAT addominale sottocutanea durante 30 minuti di esercizio di intensità moderata in individui magri riduce drasticamente la lipolisi durante l'esercizio (Arner et al., 1990b). Per illustrare ulteriormente questo punto, la delezione dell'enzima lipolitico chiave trigliceride lipasi (ATGL) dagli adipociti compromette le prestazioni acute dell'esercizio nei topi a causa della ridotta fornitura di FFA al muscolo scheletrico (Dube et al., 2015), evidenziando la necessità critica di metabolismo WAT flessibilità rispetto ad altri tessuti. L'eliminazione di ATGL dai miotubi non ha alcun effetto sulla prestazione fisica (Dube et al., 2015). Data la riduzione della densità del recettore β2-adrenergico negli adipociti isolati da individui obesi (Arner et al., 1990a; Horowitz et al., 1999), è logico che la resistenza all'azione delle catecolamine in WAT sia una possibile spiegazione per il digiuno e rilascio di FFA da WAT indotto dall'esercizio. La capacità del WAT di liberare FFA durante periodi acuti di esercizio e nel corso di ripetuti periodi di esercizio (allenamento cronico) svolge un ruolo importante nel supportare l'ossidazione del grasso corporeo intero, in particolare nel muscolo scheletrico.
Oltre ad aumentare la disponibilità di acidi grassi e glucosio per la produzione di energia durante l'attività, il muscolo scheletrico risponde anche all'esercizio acuto per preparare l'organismo al prossimo periodo di attività. Questo, in molti modi, accelera una risposta all'esercizio fisico. Questi cambiamenti riguardano anche i processi catabolici, tra cui l'autofagia (Mansueto et al., 2017) e altri processi per promuovere gli organelli e il rimodellamento cellulare per migliorare il metabolismo energetico generale. L'esercizio acuto induce cambiamenti epigenomici, trascrittomici e proteomici nel muscolo scheletrico e nel WAT, che integrano i cambiamenti nelle vie metaboliche per conferire una maggiore produzione di energia e una migliore flessibilità metabolica per i successivi periodi di esercizio. Sebbene la letteratura sia estremamente limitata al riguardo, l'esercizio cronico aumenta la metilazione dei siti CpG nei geni correlati alla lipogenesi e arricchisce l'espressione di geni correlati alla fosforilazione ossidativa e alla sintesi proteica nel WAT sottocutaneo della gamba (Ronn et al., 2013; Ronn et al. al., 2014). Questi studi recenti evidenziano come l'emergere e l'evoluzione delle tecnologie "omiche", e nuovi metodi analitici, strategie e bioinformatica possono essere implementati per interrogare i cambiamenti cellulari in risposta all'esercizio.
Alcune condizioni patologiche sono caratterizzate da rigidità metabolica durante l'esercizio?
La selezione del carburante durante l'esercizio in stati fisiopatologici come obesità, insulino-resistenza e diabete di tipo 2 ha ricevuto un'attenzione notevolmente inferiore. Nonostante abbiano ridotto l'ossidazione degli acidi grassi durante le condizioni di riposo e digiuno, i soggetti con obesità (Goodpaster et al., 2002; Horowitz e Klein, 2000) e diabete di tipo 2 (Colberg et al., 1996) hanno un grasso simile o addirittura elevato ossidazione acida durante l'esercizio. Inoltre, i pazienti con diabete di tipo 2 ossidano più glucosio plasmatico durante l'esercizio acuto (Colberg et al., 1996), il che potrebbe aiutare a spiegare parte degli effetti ipoglicemizzanti dell'esercizio e dell'attività nel diabete. La Figura 4 mette in evidenza la capacità di quantificare in modo preciso e accurato le differenze interindividuali nonché i cambiamenti acuti nella selezione del carburante dell'intero corpo umano utilizzando la calorimetria dell'intera stanza 24 ore su 24 (dati non pubblicati).
Pochi studi hanno studiato se le risposte oi cambiamenti miocellulari durante l'esercizio acuto variano a seconda dell'invecchiamento, dell'obesità o del diabete. Mandarino et al. hanno riferito che i cambiamenti nell'espressione genica indotti dall'esercizio dipendono dalla sensibilità all'insulina del muscolo scheletrico del soggetto (McLean et al., 2015). Gli studi in vitro potrebbero fornire una visione più meccanicistica delle risposte acute all'esercizio, poiché molti dei fenotipi metabolici osservati in vivo sono conservati in coltura in cellule satelliti umane isolate dal muscolo scheletrico (recensione in (Aas et al., 2013)). Ad esempio, Ukropcova et al. hanno dimostrato una flessibilità metabolica intrinseca delle cellule muscolari umane in termini di soppressione dell'ossidazione del glucosio da parte del grasso (effetto Randle) e adattabilità dell'ossidazione dei grassi a quantità crescenti di grasso (adattabilità all'alimentazione ad alto contenuto di grassi) che sono state correlate con questi stessi fenotipi osservati in vivo di i donatori (Ukropcova et al., 2005). Chiaramente, sono necessari ulteriori studi per comprendere meglio i cambiamenti cellulari che si verificano nei muscoli durante o in risposta a un esercizio acuto, che potrebbe fornire una base meccanicistica per miglioramenti dell'esercizio in salute e malattia.
Effetti dell'allenamento fisico e della perdita di peso indotta dalla restrizione calorica sulla flessibilità metabolica
L'allenamento fisico induce cambiamenti nell'epigenoma, nel trascrittoma e nel proteoma per supportare un maggiore stoccaggio di carburante e una maggiore capacità di utilizzo del substrato. In questo senso, questa flessibilità anabolica supporta una migliore flessibilità metabolica. L'esercizio fisico può promuovere tassi più elevati di ossidazione degli acidi grassi a riposo e durante l'esercizio acuto (van Loon et al., 1999). L'esercizio ha il duplice effetto di aumentare la sensibilità all'insulina (James et al., 1984), con i probabili benefici a valle della riduzione del rischio di diabete e malattie cardiovascolari. In un contesto diverso, la migliore sensibilità all'insulina con l'esercizio fisico migliora l'accumulo di glicogeno muscolare (Sherman et al., 1981), che migliora le prestazioni dell'esercizio di resistenza (Karlsson e Saltin, 1971). Diversi meccanismi plausibili possono spiegare una migliore sensibilità all'insulina e una maggiore flessibilità metabolica con l'allenamento fisico. È stato riportato che aumenti della biogenesi mitocondriale del muscolo scheletrico, del contenuto e della funzione dei mitocondri spiegano i miglioramenti sia nella sensibilità all'insulina (Coen et al., 2015a) sia nell'aumento della capacità di ossidazione degli acidi grassi (Jong-Yeon et al., 2002). La perdita di peso indotta dalla restrizione calorica migliora anche la sensibilità all'insulina (Coen et al., 2015b), ma contrariamente all'esercizio fisico, non sembra aumentare la capacità del muscolo scheletrico per l'ossidazione degli acidi grassi (Toledo e Goodpaster, 2013). Sorprendentemente, questa mancanza di miglioramenti nell'ossidazione degli acidi grassi dei mitocondri del muscolo scheletrico corrisponde alla mancanza di risposta alla perdita di peso (Coen et al., 2015a), sebbene alcuni studi abbiano dimostrato che la restrizione calorica aumenta il contenuto mitocondriale (Civitarese et al., 2007 ) e funzione (Vijgen et al., 2013).
La riduzione della massa grassa tramite la rimozione chirurgica (liposuzione) del WAT non produce risultati metabolicamente benefici (Klein et al., 2004), indicando la necessità di un rimodellamento del WAT indotto dalla restrizione calorica e/o dall'esercizio al fine di ottenere miglioramenti metabolici all'interno del tessuto adiposo. Poco si sa degli effetti dell'esercizio sulla flessibilità metabolica (in termini di insulina e reattività acuta all'esercizio) e dei relativi meccanismi molecolari nel WAT. La perdita di peso indotta dalla restrizione calorica ha un effetto più ampio sul trascrittoma in WAT rispetto alla restrizione calorica più esercizio (Lam et al., 2016). Sono necessari ulteriori studi per determinare se l'esercizio fisico e la perdita di peso possono avere caratteristiche comuni che migliorano la funzione mitocondriale, l'efficienza o riducono lo stress ossidativo concomitante con una maggiore flessibilità metabolica.
La flessibilità metabolica potrebbe essere un obiettivo per prevenire o curare le malattie?
La flessibilità metabolica comprende una varietà di percorsi e meccanismi. Nella misura in cui un obiettivo potrebbe essere coinvolto per alterare la selezione del carburante o il dispendio energetico, la flessibilità metabolica, o almeno componenti di questi, quindi, potrebbero essere bersagli vitali per la terapia. Sono stati fatti enormi sforzi per alterare la flessibilità metabolica nell'obesità e nel diabete. Una controversia chiave in quest'area è se le alterazioni nella selezione del carburante senza un concomitante aumento della domanda di energia si dimostreranno terapeutiche di fronte al sovraccarico di nutrienti o all'obesità (vedi revisione di Muoio (Muoio, 2014). Ad esempio, l'aumento del flusso di acidi grassi mitocondriali e l'ossidazione può (Bruce et al., 2009) o meno (Koves et al., 2008) migliorare la resistenza all'insulina.Nessuna delle strategie, tuttavia, aumenta il dispendio o la richiesta di energia (come l'esercizio). In poche parole, mentre le strategie per alterare il metabolismo del substrato o la flessibilità metabolica potrebbe avere un impatto sull'obesità e sulla malattia metabolica nel contesto del sovraccarico di nutrienti, senza un concomitante aumento della domanda energetica, non rappresentano un vero esercizio mimetico.
Esistono anche diversi esempi in oncologia in cui i farmaci mirati al metabolismo del tumore hanno effetti antitumorali (Chaube et al., 2015). I sensibilizzanti all'insulina hanno dimostrato di essere ragionevolmente efficaci per il trattamento del diabete di tipo 2 (Eldor et al., 2013). I farmaci che influenzano l'ossidazione degli acidi grassi, inclusi gli agonisti PPAR (Sahebkar et al., 2014), gli inibitori ACC (Bourbeau e Bartberger, 2015), sono stati sviluppati per influenzare il metabolismo energetico nell'obesità, nel diabete e nelle malattie cardiache. Anche gli attivatori dell'AMPK (AICAR, Methotrexate, Metformin) hanno mostrato risultati promettenti nel prendere di mira la flessibilità metabolica per trattare le malattie metaboliche (Hardie, 2013; Zhang et al., 2009). È interessante notare che alcuni di questi composti sono stati sviluppati e propagandati come mimetici dell'esercizio. Dato che l'esercizio influisce profondamente sulla flessibilità metabolica, sono state impiegate strategie simili per migliorare sia la flessibilità metabolica che le prestazioni sportive. Forse l'esempio recente più notevole di questo è stato l'uso documentato e ben pubblicizzato del melondrato, che è stato utilizzato da alcuni paesi (non approvato negli Stati Uniti) per inibire l'ossidazione degli acidi grassi attraverso la diminuzione della carnitina palmitoil transferasi (CPT), in per trattare la disfunzione cardiaca e il metabolismo cardiaco alterato (Arduini e Zammit, 2016). Tuttavia, c'è stata poca documentazione di qualsiasi beneficio prestazionale usando questo composto, nonostante il suo chiaro effetto sull'energia o sull'utilizzo del carburante. Qualsiasi strategia farmacologica che pretenda di imitare l'esercizio dovrebbe avere un impatto sulla flessibilità metabolica e anche indurre un aumento del dispendio energetico e della domanda simile all'esercizio. Questo dovrebbe rivelarsi impegnativo se non impossibile. In sintesi, mirare al metabolismo energetico senza effetti collaterali negativi indesiderati si è dimostrato estremamente difficile nella pratica.
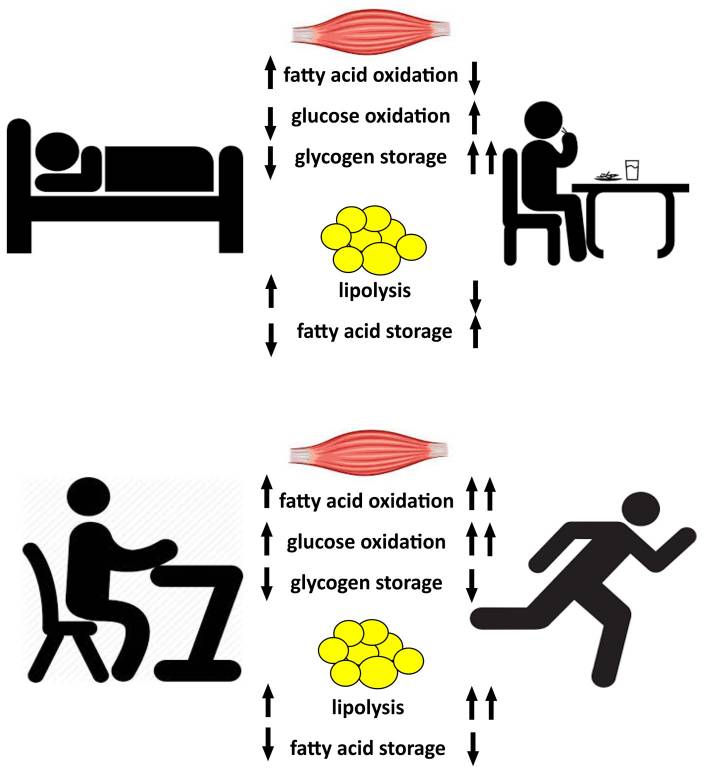
Conclusioni
Gli ampi concetti di flessibilità metabolica hanno indotto decenni di ricerche sui fattori e sui meccanismi che influenzano la disponibilità di energia e la selezione del carburante. Gran parte del lavoro iniziale si è concentrato sulla comprensione della resistenza all'insulina nel muscolo scheletrico e nei tessuti adiposi come parte di un'inflessibilità metabolica complessiva. Studi più recenti hanno studiato la flessibilità metabolica all'interno delle cellule muscolari e adipose e i loro rispettivi ruoli nella flessibilità metabolica complessiva. Gli studi che impiegano il digiuno per l'alimentazione (o la stimolazione dell'insulina), il riposo per l'esercizio o gli interventi di allenamento all'esercizio con biopsie adipose e muscolari hanno rivelato importanti indizi meccanicistici alla base della flessibilità metabolica negli esseri umani, come riassunto nella Figura 5. Gli sforzi dovrebbero essere continuati per interrogare i meccanismi e i potenziali trattamenti per la resistenza all'insulina e l'inflessibilità metabolica, compresa la capacità di ossidazione degli acidi grassi, obesità sottostante, diabete di tipo 2 e condizioni correlate.
Per approfondimenti clicca: Health Weight Loss
Bibliografia
Aas V, Bakke SS, Feng YZ, Kase ET, Jensen J, Bajpeyi S, Thoresen GH, Rustan AC. Are cultured human myotubes far from home? Cell Tissue Res. 2013;354:671–682. [PubMed] [Google Scholar]
Acheson KJ, Ravussin E, Wahren J, Jequier E. Thermic effect of glucose in man. Obligatory and facultative thermogenesis. Journal of Clinical Investigation. 1984;74:1572–1580. [PMC free article][PubMed] [Google Scholar]
Amati F, Dube JJ, Alvarez-Carnero E, Edreira MM, Chomentowski P, Coen PM, Switzer GE, Bickel PE, Stefanovic-Racic M, Toledo FG, et al. Skeletal muscle triglycerides, diacylglycerols, and ceramides in insulin resistance: another paradox in endurance-trained athletes? Diabetes. 2011;60:2588–2597. [PMC free article] [PubMed] [Google Scholar]
Andres R, Cadar G, Zierler K. The quantitatively minor role of carbohydrate in oxidative metabolism by skeletal muscle in intact man in the basal state. Journal of Clinical Investigation. 1956;35:671–682. [PMC free article] [PubMed] [Google Scholar]
Arduini A, Zammit VA. A tennis lesson: sharp practice in the science behind the Sharapova case. Postgrad Med J. 2016;92:429–430. [PMC free article] [PubMed] [Google Scholar]
Arner P. Differences in lipolysis between human subcutaneous and omental adipose tissues. Ann Med. 1995;27:435–438. [PubMed] [Google Scholar]
Arner P, Hellstrom L, Wahrenberg H, Bronnegard M. Beta-adrenoceptor expression in human fat cells from different regions. The Journal of clinical investigation. 1990a;86:1595–1600.[PMC free article] [PubMed] [Google Scholar]
Arner P, Kriegholm E, Engfeldt P, Bolinder J. Adrenergic regulation of lipolysis in situ at rest and during exercise. The Journal of clinical investigation. 1990b;85:893–898. [PMC free article][PubMed] [Google Scholar]
Bass J, Lazar MA. Circadian time signatures of fitness and disease. Science. 2016;354:994–999.[PubMed] [Google Scholar]
Bostrom P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, Rasbach KA, Bostrom EA, Choi JH, Long JZ, et al. A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012;481:463–468. [PMC free article] [PubMed] [Google Scholar]
Bourbeau MP, Bartberger MD. Recent advances in the development of acetyl-CoA carboxylase (ACC) inhibitors for the treatment of metabolic disease. J Med Chem. 2015;58:525–536. [PubMed] [Google Scholar]
Brehm A, Krssak M, Schmid AI, Nowotny P, Waldhausl W, Roden M. Increased lipid availability impairs insulin-stimulated ATP synthesis in human skeletal muscle. Diabetes. 2006;55:136–140.[PubMed] [Google Scholar]
Brooks GA. Importance of the ‘crossover’ concept in exercise metabolism. Clinical & Experimental Pharmacology & Physiology. 1997;24:889–895. [PubMed] [Google Scholar]
Bruce CR, Hoy AJ, Turner N, Watt MJ, Allen TL, Carpenter K, Cooney GJ, Febbraio MA, Kraegen EW. Overexpression of carnitine palmitoyltransferase-1 in skeletal muscle is sufficient to enhance fatty acid oxidation and improve high-fat diet-induced insulin resistance. Diabetes. 2009;58:550–558. [PMC free article] [PubMed] [Google Scholar]
Campbell PJ, Carlson MG, Nurjhan N. Fat metabolism in human obesity. Am J Physiol. 1994;266:E600–605. [PubMed] [Google Scholar]
Chaube B, Malvi P, Singh SV, Mohammad N, Meena AS, Bhat MK. Targeting metabolic flexibility by simultaneously inhibiting respiratory complex I and lactate generation retards melanoma progression. Oncotarget. 2015;6:37281–37299. [PMC free article] [PubMed] [Google Scholar]
Chen DL, Liess C, Poljak A, Xu A, Zhang J, Thoma C, Trenell M, Milner B, Jenkins AB, Chisholm DJ, et al. Phenotypic Characterization of Insulin-Resistant and Insulin-Sensitive Obesity. J Clin Endocrinol Metab. 2015;100:4082–4091. [PubMed] [Google Scholar]
Choi SM, Tucker DF, Gross DN, Easton RM, DiPilato LM, Dean AS, Monks BR, Birnbaum MJ. Insulin regulates adipocyte lipolysis via an Akt-independent signaling pathway. Mol Cell Biol. 2010;30:5009–5020. [PMC free article] [PubMed] [Google Scholar]
Civitarese AE, Carling S, Heilbronn LK, Hulver MH, Ukropcova B, Deutsch WA, Smith SR, Ravussin E, Team CP. Calorie restriction increases muscle mitochondrial biogenesis in healthy humans. PLoS Med. 2007;4:e76. [PMC free article] [PubMed] [Google Scholar]
Coen PM, Dube JJ, Amati F, Stefanovic-Racic M, Ferrell RE, Toledo FG, Goodpaster BH. Insulin resistance is associated with higher intramyocellular triglycerides in type I but not type II myocytes concomitant with higher ceramide content. Diabetes. 2010;59:80–88. [PMC free article] [PubMed] [Google Scholar]
Coen PM, Menshikova EV, Distefano G, Zheng D, Tanner CJ, Standley RA, Helbling NL, Dubis GS, Ritov VB, Xie H, et al. Exercise and Weight Loss Improve Muscle Mitochondrial Respiration, Lipid Partitioning, and Insulin Sensitivity After Gastric Bypass Surgery. Diabetes. 2015a;64:3737–3750.[PMC free article] [PubMed] [Google Scholar]
Coen PM, Tanner CJ, Helbling NL, Dubis GS, Hames KC, Xie H, Eid GM, Stefanovic-Racic M, Toledo FG, Jakicic JM, et al. Clinical trial demonstrates exercise following bariatric surgery improves insulin sensitivity. The Journal of clinical investigation. 2015b;125:248–257.[PMC free article] [PubMed] [Google Scholar]
Colberg SR, Hagberg JM, McCole SD, Zmuda JM, Thompson PD, Kelley DE. Utilization of glycogen but not plasma glucose is reduced in individuals with NIDDM during mild-intensity exercise. Journal of Applied Physiology. 1996;81:2027–2033. [PubMed] [Google Scholar]
DeFronzo RA, Tripathy D. Skeletal muscle insulin resistance is the primary defect in type 2 diabetes. Diabetes Care. 2009;32(Suppl 2):S157–163. [PMC free article] [PubMed] [Google Scholar]
Divertie GD, Jensen MD, Miles JM. Stimulation of lipolysis in humans by physiological hypercortisolemia. Diabetes. 1991;40:1228–1232. [PubMed] [Google Scholar]
Dube JJ, Coen PM, DiStefano G, Chacon AC, Helbling NL, Desimone ME, Stafanovic-Racic M, Hames KC, Despines AA, Toledo FG, et al. Effects of acute lipid overload on skeletal muscle insulin resistance, metabolic flexibility, and mitochondrial performance. American journal of physiology. Endocrinology and metabolism. 2014;307:E1117–1124. [PMC free article] [PubMed] [Google Scholar]
Dube JJ, Sitnick MT, Schoiswohl G, Wills RC, Basantani MK, Cai L, Pulinilkunnil T, Kershaw EE. Adipose triglyceride lipase deletion from adipocytes, but not skeletal myocytes, impairs acute exercise performance in mice. American journal of physiology. Endocrinology and metabolism. 2015;308:E879–890. [PMC free article] [PubMed] [Google Scholar]
Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet. 2005;365:1415–1428.[PubMed] [Google Scholar]
Egan B, Zierath JR. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell metabolism. 2013;17:162–184. [PubMed] [Google Scholar]
Eldor R, DeFronzo RA, Abdul-Ghani M. In vivo actions of peroxisome proliferator-activated receptors: glycemic control, insulin sensitivity, and insulin secretion. Diabetes Care. 2013;36(Suppl 2):S162–174. [PMC free article] [PubMed] [Google Scholar]
Falta W, Boller R. Insularer und Insulinresistenter Diabetes. Klinische Wochenschrift. 1931;10:438–443. [Google Scholar]
Flier JS, Kahn CR, Roth J. Receptors, antireceptor antibodies and mechanisms of insulin resistance. N Engl J Med. 1979;300:413–419. [PubMed] [Google Scholar]
Fox CS, Massaro JM, Hoffmann U, Pou KM, Maurovich-Horvat P, Liu CY, Vasan RS, Murabito JM, Meigs JB, Cupples LA, et al. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham Heart Study. Circulation. 2007;116:39–48. [PubMed] [Google Scholar]
Frayn KN, Coppack SW. Insulin resistance, adipose tissue and coronary heart disease. Clin Sci (Lond) 1992;82:1–8. [PubMed] [Google Scholar]
Frayn KN, Williams CM, Arner P. Are increased plasma non-esterified fatty acid concentrations a risk marker for coronary heart disease and other chronic diseases? Clin Sci (Lond) 1996;90:243–253.[PubMed] [Google Scholar]
Girard J. Mechanisms of action of thiazolidinediones. Diabetes Metab. 2001;27:271–278. [PubMed] [Google Scholar]
Goodpaster B, Kelley D. In: Metabolic inflexibility and insulin resistance in skeletal muscle. In Physical Activity and Type 2 Diabetes. Hawley, Zierath, editors. Champaign: Human Kinetics; 2008. pp. 59–66. [Google Scholar]
Goodpaster BH, Costill DL, Fink WJ, Trappe TA, Jozsi AC, Starling RD, Trappe SW. The effects of pre-exercise starch ingestion on endurance performance. Int J Sports Med. 1996;17:366–372.[PubMed] [Google Scholar]
Goodpaster BH, Wolfe RR, Kelley DE. Effects of obesity on substrate utilization during exercise. Obes Res. 2002;10:575–584. [PubMed] [Google Scholar]
Goodyear LJ, Kahn BB. Exercise, glucose transport, and insulin sensitivity. Annual review of medicine. 1998;49:235–261. [PubMed] [Google Scholar]
Groop LC, Bonadonna RC, DelPrato S, Ratheiser K, Zyck K, Ferrannini E, DeFronzo RA. Glucose and free fatty acid metabolism in non-insulin-dependent diabetes mellitus. Evidence for multiple sites of insulin resistance. The Journal of clinical investigation. 1989;84:205–213. [PMC free article][PubMed] [Google Scholar]
Guan HP, Li Y, Jensen MV, Newgard CB, Steppan CM, Lazar MA. A futile metabolic cycle activated in adipocytes by antidiabetic agents. Nat Med. 2002;8:1122–1128. [PubMed] [Google Scholar]
Hansen M, Morthorst R, Larsson B, Dall R, Flyvbjerg A, Rasmussen MH, Orskov H, Kjaer M, Lange KH. No effect of growth hormone administration on substrate oxidation during exercise in young, lean men. J Physiol. 2005;567:1035–1045. [PMC free article] [PubMed] [Google Scholar]
Hardie DG. AMPK: a target for drugs and natural products with effects on both diabetes and cancer. Diabetes. 2013;62:2164–2172. [PMC free article] [PubMed] [Google Scholar]
Hawley JA, Hargreaves M, Joyner MJ, Zierath JR. Integrative biology of exercise. Cell. 2014;159:738–749. [PubMed] [Google Scholar]
Healy ML, Gibney J, Pentecost C, Croos P, Russell-Jones DL, Sonksen PH, Umpleby AM. Effects of high-dose growth hormone on glucose and glycerol metabolism at rest and during exercise in endurance-trained athletes. J Clin Endocrinol Metab. 2006;91:320–327. [PubMed] [Google Scholar]
Henderson GC, Fattor JA, Horning MA, Faghihnia N, Johnson ML, Mau TL, Luke-Zeitoun M, Brooks GA. Lipolysis and fatty acid metabolism in men and women during the postexercise recovery period. J Physiol. 2007;584:963–981. [PMC free article] [PubMed] [Google Scholar]
Hoeks J, van Herpen NA, Mensink M, Moonen-Kornips E, van Beurden D, Hesselink MK, Schrauwen P. Prolonged fasting identifies skeletal muscle mitochondrial dysfunction as consequence rather than cause of human insulin resistance. Diabetes. 2010;59:2117–2125. [PMC free article][PubMed] [Google Scholar]
Hoffman NJ, Parker BL, Chaudhuri R, Fisher-Wellman KH, Kleinert M, Humphrey SJ, Yang P, Holliday M, Trefely S, Fazakerley DJ, et al. Global Phosphoproteomic Analysis of Human Skeletal Muscle Reveals a Network of Exercise-Regulated Kinases and AMPK Substrates. Cell metabolism. 2015;22:922–935. [PMC free article] [PubMed] [Google Scholar]
Holland WL, Summers SA. Sphingolipids, insulin resistance, and metabolic disease: new insights from in vivo manipulation of sphingolipid metabolism. Endocrine reviews. 2008;29:381–402.[PMC free article] [PubMed] [Google Scholar]
Horowitz JF. Fatty acid mobilization from adipose tissue during exercise. Trends Endocrinol Metab. 2003;14:386–392. [PubMed] [Google Scholar]
Horowitz JF, Klein S. Oxidation of nonplasma fatty acids during exercise is increased in women with abdominal obesity. [see comments]. Comment in: J Appl Physiol. 2001 Jun;90(6):2520–1. Journal of Applied Physiology. 2000;89:2276–2282. [PubMed] [Google Scholar]
Horowitz JF, Mora-Rodriguez R, Byerley LO, Coyle EF. Substrate metabolism when subjects are fed carbohydrate during exercise. Am J Physiol. 1999;276:E828–835. [PubMed] [Google Scholar]
Itani SI, Rudderman NB, Schmieder F, Boden G. Lipid-induced insulin resistance in human muscle is associated with changes in diacylglycerol, protein kinase C and IkB-a. Diabetes. 2002;51:2005–2011. [PubMed] [Google Scholar]
James DE, Kraegen EW, Chisholm DJ. Effect of exercise training on whole-body insulin sensitivity and responsiveness. J Appl Physiol. 1984;56:1217–1222. [PubMed] [Google Scholar]
Jensen MD. Adipose tissue and fatty acid metabolism in humans. J R Soc Med. 2002;95(Suppl 42):3–7. [PMC free article] [PubMed] [Google Scholar]
Jensen MD, Ekberg K, Landau BR. Lipid metabolism during fasting. American journal of physiology. Endocrinology and metabolism. 2001;281:E789–793. [PubMed] [Google Scholar]
Jeukendrup AE. Regulation of fat metabolism in skeletal muscle. Ann N Y Acad Sci. 2002;967:217–235. [PubMed] [Google Scholar]
Jeukendrup AE, Saris WH, Van Diesen R, Brouns F, Wagenmakers AJ. Effect of endogenous carbohydrate availability on oral medium-chain triglyceride oxidation during prolonged exercise. Journal of Applied Physiology. 1996;80:949–954. [PubMed] [Google Scholar]
Jeukendrup AE, Saris WH, Wagenmakers AJ. Fat metabolism during exercise: a review--part III: effects of nutritional interventions. [Review] [97 refs] International Journal of Sports Medicine. 1998a;19:371–379. [PubMed] [Google Scholar]
Jeukendrup AE, Thielen JJ, Wagenmakers AJ, Brouns F, Saris WH. Effect of medium-chain triacylglycerol and carbohydrate ingestion during exercise on substrate utilization and subsequent cycling performance. Am J Clin Nutr. 1998b;67:397–404. [PubMed] [Google Scholar]
Jing E, Emanuelli B, Hirschey MD, Boucher J, Lee KY, Lombard D, Verdin EM, Kahn CR. Sirtuin-3 (Sirt3) regulates skeletal muscle metabolism and insulin signaling via altered mitochondrial oxidation and reactive oxygen species production. Proc Natl Acad Sci U S A. 2011;108:14608–14613. [PMC free article] [PubMed] [Google Scholar]
Jong-Yeon K, Hickner RC, Dohm GL, Houmard JA. Long- and medium-chain fatty acid oxidation is increased in exercise-trained human skeletal muscle. Metabolism: Clinical & Experimental. 2002;51:460–464. [PubMed] [Google Scholar]
Jorgensen SB, Richter EA, Wojtaszewski JF. Role of AMPK in skeletal muscle metabolic regulation and adaptation in relation to exercise. J Physiol. 2006;574:17–31. [PMC free article] [PubMed] [Google Scholar]
Karlsson J, Saltin B. Diet, muscle glycogen, and endurance performance. Journal of Applied Physiology. 1971;31:203–206. [PubMed] [Google Scholar]
Karpe F, Dickmann JR, Frayn KN. Fatty acids, obesity, and insulin resistance: time for a reevaluation. Diabetes. 2011;60:2441–2449. [PMC free article] [PubMed] [Google Scholar]
Keller P, Vollaard NB, Gustafsson T, Gallagher IJ, Sundberg CJ, Rankinen T, Britton SL, Bouchard C, Koch LG, Timmons JA. A transcriptional map of the impact of endurance exercise training on skeletal muscle phenotype. J Appl Physiol (1985) 2011;110:46–59. [PMC free article] [PubMed] [Google Scholar]
Kelley DE, Simoneau JA. Impaired free fatty acid utilization by skeletal muscle in non-insulin-dependent diabetes mellitus. J Clin Invest. 1994;94:2349–2356. [PMC free article] [PubMed] [Google Scholar]
Kelley DE, Goodpaster B, Wing RR, Simoneau JA. Skeletal muscle fatty acid metabolism in association with insulin resistance, obesity, and weight loss. Am J Physiol. 1999;277:E1130–1141.[PubMed] [Google Scholar]
Kelley DE, Mokan M, Simoneau J, Mandarino LJ. Interaction between glucose and free fatty acid metabolism in human skeletal muscle. J Clin Invest. 1993;92:91–98. [PMC free article] [PubMed] [Google Scholar]
Kelley DE, Mandarino LJ. Hyperglycemia normalizes insulin-stimulated skeletal muscle glucose oxidation and storage in noninsulin-dependent diabetes mellitus. Journal of Clinical Investigation. 1990;86:1999–2007. [PMC free article] [PubMed] [Google Scholar]
Kelley DE, Mokan M, Simoneau JA, Mandarino LJ. Interaction between glucose and free fatty acid metabolism in human skeletal muscle. Journal of Clinical Investigation. 1993;92:91–98.[PMC free article] [PubMed] [Google Scholar]
Klein S, Fontana L, Young VL, Coggan AR, Kilo C, Patterson BW, Mohammed BS. Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. N Engl J Med. 2004;350:2549–2557. [PubMed] [Google Scholar]
Kohler P. The strategies of energy conservation in helminths. Mol Biochem Parasitol. 1985;17:1–18.[PubMed] [Google Scholar]
Koves TR, Ussher JR, Noland RC, Slentz D, Mosedale M, Ilkayeva O, Bain J, Stevens R, Dyck JR, Newgard CB, et al. Mitochondrial overload and incomplete fatty acid oxidation contribute to skeletal muscle insulin resistance. Cell metabolism. 2008;7:45–56. [PubMed] [Google Scholar]
Lam YY, Ghosh S, Civitarese AE, Ravussin E. Six-month Calorie Restriction in Overweight Individuals Elicits Transcriptomic Response in Subcutaneous Adipose Tissue That is Distinct From Effects of Energy Deficit. J Gerontol A Biol Sci Med Sci. 2016;71:1258–1265. [PMC free article][PubMed] [Google Scholar]
Lee HY, Choi CS, Birkenfeld AL, Alves TC, Jornayvaz FR, Jurczak MJ, Zhang D, Woo DK, Shadel GS, Ladiges W, et al. Targeted expression of catalase to mitochondria prevents age-associated reductions in mitochondrial function and insulin resistance. Cell metabolism. 2010;12:668–674.[PMC free article] [PubMed] [Google Scholar]
Lehmann JM, Moore LB, Smith-Oliver TA, Wilkison WO, Willson TM, Kliewer SA. An antidiabetic thiazolidinedione is a high affinity ligand for peroxisome proliferator-activated receptor gamma (PPAR gamma) J Biol Chem. 1995;270:12953–12956. [PubMed] [Google Scholar]
Mansueto G, Armani A, Viscomi C, D’Orsi L, De Cegli R, Polishchuk EV, Lamperti C, Di Meo I, Romanello V, Marchet S, et al. Transcription Factor EB Controls Metabolic Flexibility during Exercise. Cell metabolism. 2017;25:182–196. [PMC free article] [PubMed] [Google Scholar]
Matthews DR. Oscillatory insulin secretion: a variable phenotypic marker. Diabet Med. 1996;13:S53–58. [PubMed] [Google Scholar]
Mauriege P, Galitzky J, Berlan M, Lafontan M. Heterogeneous distribution of beta and alpha-2 adrenoceptor binding sites in human fat cells from various fat deposits: functional consequences. Eur J Clin Invest. 1987;17:156–165. [PubMed] [Google Scholar]
McGarry JD. What if Minkowski had been ageusic? An alternative angle on diabetes. Science. 1992;258:766–770. [PubMed] [Google Scholar]
McLean CS, Mielke C, Cordova JM, Langlais PR, Bowen B, Miranda D, Coletta DK, Mandarino LJ. Gene and MicroRNA Expression Responses to Exercise; Relationship with Insulin Sensitivity. PLoS One. 2015;10:e0127089. [PMC free article] [PubMed] [Google Scholar]
McMurray RG, Forsythe WA, Mar MH, Hardy CJ. Exercise intensity-related responses of beta-endorphin and catecholamines. Med Sci Sports Exerc. 1987;19:570–574. [PubMed] [Google Scholar]
McQuaid SE, Hodson L, Neville MJ, Dennis AL, Cheeseman J, Humphreys SM, Ruge T, Gilbert M, Fielding BA, Frayn KN, et al. Downregulation of adipose tissue fatty acid trafficking in obesity: a driver for ectopic fat deposition? Diabetes. 2011;60:47–55. [PMC free article] [PubMed] [Google Scholar]
Morino K, Petersen KF, Dufour S, Befroy D, Frattini J, Shatzkes N, Neschen S, White MF, Bilz S, Sono S, et al. Reduced mitochondrial density and increased IRS-1 serine phosphorylation in muscle of insulin-resistant offspring of type 2 diabetic parents. The Journal of clinical investigation. 2005;115:3587–3593. [PMC free article] [PubMed] [Google Scholar]
Muoio DM. Metabolic inflexibility: when mitochondrial indecision leads to metabolic gridlock. Cell. 2014;159:1253–1262. [PMC free article] [PubMed] [Google Scholar]
Narkar VA, Downes M, Yu RT, Embler E, Wang YX, Banayo E, Mihaylova MM, Nelson MC, Zou Y, Juguilon H, et al. AMPK and PPARdelta agonists are exercise mimetics. Cell. 2008;134:405–415.[PMC free article] [PubMed] [Google Scholar]
Nedergaard J, Cannon B. The browning of white adipose tissue: some burning issues. Cell metabolism. 2014;20:396–407. [PubMed] [Google Scholar]
Ng JM, Azuma K, Kelley C, Pencek R, Radikova Z, Laymon C, Price J, Goodpaster BH, Kelley DE. PET imaging reveals distinctive roles for different regional adipose tissue depots in systemic glucose metabolism in nonobese humans. American journal of physiology. Endocrinology and metabolism. 2012;303:E1134–1141. [PMC free article] [PubMed] [Google Scholar]
Nielsen S, Guo Z, Johnson CM, Hensrud DD, Jensen MD. Splanchnic lipolysis in human obesity. The Journal of clinical investigation. 2004;113:1582–1588. [PMC free article] [PubMed] [Google Scholar]
Nurjhan N, Campbell PJ, Kennedy FP, Miles JM, Gerich JE. Insulin dose-response characteristics for suppression of glycerol release and conversion to glucose in humans. Diabetes. 1986;35:1326–1331.[PubMed] [Google Scholar]
O’Rahilly S, Turner RC, Matthews DR. Impaired pulsatile secretion of insulin in relatives of patients with non-insulin-dependent diabetes. N Engl J Med. 1988;318:1225–1230. [PubMed] [Google Scholar]
Petersen KF, Dufour S, Savage DB, Bilz S, Solomon G, Yonemitsu S, Cline GW, Befroy D, Zemany L, Kahn BB, et al. The role of skeletal muscle insulin resistance in the pathogenesis of the metabolic syndrome. Proc Natl Acad Sci U S A. 2007;104:12587–12594. [PMC free article] [PubMed] [Google Scholar]
Pette D. In: Plasticity of Muscle. Gruyter d., editor. Berlin: 1980. [Google Scholar]
Phielix E, Meex R, Ouwens DM, Sparks L, Hoeks J, Schaart G, Moonen-Kornips E, Hesselink MK, Schrauwen P. High oxidative capacity due to chronic exercise training attenuates lipid-induced insulin resistance. Diabetes. 2012;61:2472–2478. [PMC free article] [PubMed] [Google Scholar]
Randle PJ, Garland PB, Hales CN, Newsholme EA. The glucose fatty-acid cycle. Its role in insulin sensitivity and the metabolic disturbances of diabetes mellitus. Lancet. 1963;1:785–789. [PubMed] [Google Scholar]
Rasmussen M, Zierath JR, Barres R. Dynamic epigenetic responses to muscle contraction. Drug discovery today. 2014;19:1010–1014. [PubMed] [Google Scholar]
Raue U, Trappe TA, Estrem ST, Qian HR, Helvering LM, Smith RC, Trappe S. Transcriptome signature of resistance exercise adaptations: mixed muscle and fiber type specific profiles in young and old adults. J Appl Physiol (1985) 2012;112:1625–1636. [PMC free article] [PubMed] [Google Scholar]
Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes. 1988;37:1595–1607. [PubMed] [Google Scholar]
Reitman ML, Gavrilova O. A-ZIP/F-1 mice lacking white fat: a model for understanding lipoatrophic diabetes. International Journal of Obesity & Related Metabolic Disorders: Journal of the International Association for the Study of Obesity. 2000;24:S11–14. [PubMed] [Google Scholar]
Reshef L, Olswang Y, Cassuto H, Blum B, Croniger CM, Kalhan SC, Tilghman SM, Hanson RW. Glyceroneogenesis and the triglyceride/fatty acid cycle. J Biol Chem. 2003;278:30413–30416.[PubMed] [Google Scholar]
Romijn JA, Coyle EF, Sidossis LS, Gastaldelli A, Horowitz JF, Endert E, Wolfe RR. Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. Am J Physiol Endocrinol Metab. 1993;265:E380–E391. [PubMed] [Google Scholar]
Ronn T, Volkov P, Davegardh C, Dayeh T, Hall E, Olsson AH, Nilsson E, Tornberg A, Dekker Nitert M, Eriksson KF, et al. A six months exercise intervention influences the genome-wide DNA methylation pattern in human adipose tissue. PLoS Genet. 2013;9:e1003572. [PMC free article][PubMed] [Google Scholar]
Ronn T, Volkov P, Tornberg A, Elgzyri T, Hansson O, Eriksson KF, Groop L, Ling C. Extensive changes in the transcriptional profile of human adipose tissue including genes involved in oxidative phosphorylation after a 6-month exercise intervention. Acta Physiol (Oxf) 2014;211:188–200.[PubMed] [Google Scholar]
Sahebkar A, Chew GT, Watts GF. New peroxisome proliferator-activated receptor agonists: potential treatments for atherogenic dyslipidemia and non-alcoholic fatty liver disease. Expert Opin Pharmacother. 2014;15:493–503. [PubMed] [Google Scholar]
Savage DB, Petersen KF, Shulman GI. Disordered lipid metabolism and the pathogenesis of insulin resistance. Physiol Rev. 2007;87:507–520. [PMC free article] [PubMed] [Google Scholar]
Schwartz RS, Shuman WP, Larson V, Cain KC, Fellingham GW, Beard JC, Kahn SE, Stratton JR, Cerqueira MD, Abrass IB. The effect of intensive endurance exercise training on body fat distribution in young and older men. Metabolism. 1991;40:545–551. [PubMed] [Google Scholar]
Sherman WM, Costill DL, Fink WJ, Miller JM. Effect of exercise-diet manipulation on muscle glycogen and its subsequent utilization during performance. International Journal of Sports Medicine. 1981;2:114–118. [PubMed] [Google Scholar]
Shulman GI. Unraveling the cellular mechanism of insulin resistance in humans: new insights from magnetic resonance spectroscopy. Physiology. 2004;19:183–190. [PubMed] [Google Scholar]
Sparks LM, Ukropcova B, Smith J, Pasarica M, Hymel D, Xie H, Bray GA, Miles JM, Smith SR. Relation of adipose tissue to metabolic flexibility. Diabetes Res Clin Pract. 2009;83:32–43.[PMC free article] [PubMed] [Google Scholar]
Stallknecht B, Dela F, Helge JW. Are blood flow and lipolysis in subcutaneous adipose tissue influenced by contractions in adjacent muscles in humans? American journal of physiology. Endocrinology and metabolism. 2007;292:E394–399. [PubMed] [Google Scholar]
Stallknecht B, Lorentsen J, Enevoldsen LH, Bulow J, Biering-Sorensen F, Galbo H, Kjaer M. Role of the sympathoadrenergic system in adipose tissue metabolism during exercise in humans. J Physiol. 2001;536:283–294. [PMC free article] [PubMed] [Google Scholar]
Stanford KI, Middelbeek RJ, Goodyear LJ. Exercise Effects on White Adipose Tissue: Beiging and Metabolic Adaptations. Diabetes. 2015;64:2361–2368. [PMC free article] [PubMed] [Google Scholar]
Stich V, de Glisezinski I, Berlan M, Bulow J, Galitzky J, Harant I, Suljkovicova H, Lafontan M, Riviere D, Crampes F. Adipose tissue lipolysis is increased during a repeated bout of aerobic exercise. J Appl Physiol (1985) 2000;88:1277–1283. [PubMed] [Google Scholar]
Thomas EL, Brynes AE, McCarthy J, Goldstone AP, Hajnal JV, Saeed N, Frost G, Bell JD. Preferential loss of visceral fat following aerobic exercise, measured by magnetic resonance imaging. Lipids. 2000;35:769–776. [PubMed] [Google Scholar]
Toledo FG, Goodpaster BH. The role of weight loss and exercise in correcting skeletal muscle mitochondrial abnormalities in obesity, diabetes and aging. Mol Cell Endocrinol. 2013;379:30–34.[PubMed] [Google Scholar]
Turner N, Kowalski GM, Leslie SJ, Risis S, Yang C, Lee-Young RS, Babb JR, Meikle PJ, Lancaster GI, Henstridge DC, et al. Distinct patterns of tissue-specific lipid accumulation during the induction of insulin resistance in mice by high-fat feeding. Diabetologia. 2013;56:1638–1648. [PubMed] [Google Scholar]
Ukropcova B, McNeil M, Sereda O, de Jonge L, Xie H, Bray GA, Smith SR. Dynamic changes in fat oxidation in human primary myocytes mirror metabolic characteristics of the donor. The Journal of clinical investigation. 2005;115:1934–1941. [PMC free article] [PubMed] [Google Scholar]
Ukropcova B, Sereda O, de Jonge L, Bogacka I, Nguyen T, Xie H, Bray GA, Smith SR. Family history of diabetes links impaired substrate switching and reduced mitochondrial content in skeletal muscle. Diabetes. 2007;56:720–727. [PubMed] [Google Scholar]
van Loon LJ, Jeukendrup AE, Saris WH, Wagenmakers AJ. Effect of training status on fuel selection during submaximal exercise with glucose ingestion. Journal of Applied Physiology. 1999;87:1413–1420. [PubMed] [Google Scholar]
Vijgen GH, Bouvy ND, Hoeks J, Wijers S, Schrauwen P, van Marken Lichtenbelt WD. Impaired skeletal muscle mitochondrial function in morbidly obese patients is normalized one year after bariatric surgery. Surg Obes Relat Dis. 2013;9:936–941. [PubMed] [Google Scholar]
Yu C, Chen Y, Cline GW, Zhang D, Zong H, Wang Y, Bergeron R, Kim JK, Cushman SW, Cooney GJ, Atcheson B, White MF, Kraegen EW, Shulman GI. Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1 (IRS-1)-associated phosphatidylinositol 3-kinase activity in muscle. J Biol Chem. 2002;277:50230–50236. [PubMed] [Google Scholar]
Yu XX, Lewin DA, Forrest W, Adams SH. Cold elicits the simultaneous induction of fatty acid synthesis and beta-oxidation in murine brown adipose tissue: prediction from differential gene expression and confirmation in vivo. FASEB J. 2002;16:155–168. [PubMed] [Google Scholar]
Zhang BB, Zhou G, Li C. AMPK: an emerging drug target for diabetes and the metabolic syndrome. Cell metabolism. 2009;9:407–416. [PubMed] [Google Scholar]







Comments